Quando foi inventado o sabonete, conte para você
O que é sabão, oficialmente?
Grande parte da confusão com a definição oficial ocorre entre a verdadeira sabão e produtos de limpeza sintéticos – o que o FDA chama de “detergentes”. O verdadeiro Sabonete, ou sabonete comum, é definido como a “combinação de gorduras ou óleos com um álcali, como a soda cáustica”. Muitas dessas barras nas prateleiras, e muitos desses frascos com bomba, não são sabonetes, mas uma mistura de produtos sintéticos, muitos deles incluídos para compensar a natureza essencial dos detergentes para remover a pele.
O FDA não faz distinção entre sabonete feito com gorduras vegetais e sabonete feito com sebo. Eles não fazem nenhuma tentativa de definir o sabonete orgânico. Existe uma tarefa simples. Até a regulamentação do sabonete cabe a uma agência governamental diferente, a Comissão de Segurança de Produtos de Consumo. Ainda assim, não são apenas os ingredientes que determinam se um produto se enquadra na definição regulamentar de sabonete. Existem mais duas variáveis a considerar. Aqui está uma definição útil de três pontos:
- Ingredientes. Para ser regulamentado como sabonete, um produto deve ser composto principalmente de “sais alcalinos de ácidos graxos”, ou seja, o que você obtém quando combina ácidos graxos com soda cáustica.
- Como isso limpa. Os “sais alcalinos de ácidos graxos” devem ser o único ingrediente que proporciona ação de limpeza. Se os produtos sintéticos adicionados desempenharem um papel, o produto não será mais um sabonete, mas um cosmético.
- Seu uso pretendido. Para ser regulamentado como sabonete, um produto deve ser rotulado e comercializado apenas como sabonete. Se a intenção é hidratar a pele, desodorizar a pele ou deixar a pele cheirosa, não é mais sabonete, mas sim um cosmético. Se o objetivo é tratar eczema ou prevenir doenças matando germes, não é mais sabão. É oficialmente uma droga.

Quando o sabonete foi inventado
Os registos mostram que o sabão foi produzido já em 2800 AC pelos antigos babilónios, mas o sabão tornou-se particularmente popular durante a era vitoriana, quando a produção em massa se tornou viável após a revolução industrial. Isto, combinado com uma crescente compreensão das práticas sanitárias e da publicidade para incentivar o banho com sabonete, garantiu que o humilde sabonete rapidamente se tornasse um objeto doméstico essencial.

Qual é a fórmula do sabonete
Durante séculos, os humanos conheceram a receita básica do sabonete – é uma reação entre gorduras e uma base forte. A fórmula química exata é C17H35COO- mais um cátion metálico, Na+ ou K+. A molécula final é chamada de estearato de sódio e é um tipo de sal. Dependendo do cátion metálico, os sabões são sais de potássio ou sais de sódio dispostos como ácidos carboxílicos de cadeia longa.
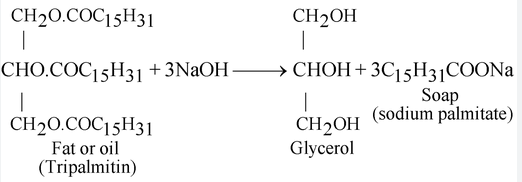
Normalmente, a formação dessas cadeias envolve a combinação de hidróxido de potássio com uma gordura animal ou vegetal, ou às vezes com ácido acético. Uma molécula de sabão faz duas coisas – liga-se à água e aos detritos. Isso se deve aos seus componentes hidrofílicos, ou “amantes da água”, e hidrofóbicos, ou “temerosos da água”. Uma molécula de sabão tem uma “cabeça” aniônica hidrofílica e uma “cauda” hidrofóbica feita de hidrocarbonetos. A cabeça das moléculas é atraída e se dissolve na água, enquanto a cauda do hidrocarboneto é atraída pela sujeira e pela gordura e repelida pela água.
O sabão também é um surfactante – reduz a tensão superficial da água. A água tem uma forte tensão superficial , o que faz com que gotas caiam em uma variedade de superfícies, desde metal até tecido. Isso retarda o processo de umedecimento da água e inibe sua capacidade de limpeza. Como os sabonetes diminuem a tensão superficial da água, ela pode se espalhar e molhar com mais facilidade. Além disso, os surfactantes soltam e emulsificam a sujeira e os detritos, dispersando-os na água e permitindo que sejam enxaguados.
Hoje, o processo de fabricação de sabão envolve mais comumente a reação de um ácido orgânico com produtos químicos alcalinos, como hidróxido de potássio ou hidróxido de sódio. Industrialmente, a base de soda cáustica usada com mais frequência é o hidróxido de sódio, também chamado de soda cáustica. A principal diferença entre os sabonetes de potássio e de sódio é a consistência – geralmente, o potássio produz um sabonete mais macio e solúvel em água do que o de sódio.
Como funciona o sabonete?
O sabonete é capaz de limpar mãos e pratos por causa de uma química muito bacana. As moléculas de sabão têm em uma extremidade o que é conhecido como sal polar, que é hidrofílico ou atraído pela água. A outra extremidade da molécula é uma cadeia apolar de ácidos graxos ou hidrocarbonetos, que é hidrofóbica, o que significa que é repelida pela água, mas atraída por gordura e outras substâncias oleosas. Quando você lava as mãos, o sabonete forma algo como uma ponte molecular entre a água e os óleos sujos e carregados de germes em suas mãos, fixando-se tanto nos óleos quanto na água e removendo a sujeira. Os sabonetes também podem se ligar às membranas gordurosas do lado de fora das bactérias e de certos vírus, eliminando os agentes infecciosos e até mesmo quebrando-os. Depois que a sujeira oleosa e os germes saem de suas mãos, as moléculas de sabão as envolvem completamente e formam pequenos aglomerados, conhecidos como micelas, que as impedem de se fixarem em qualquer outra coisa enquanto descem pelo ralo.