O sabonete é um ácido ou uma base e como funciona?
O que é Sabonete?
Em química, sabão é um sal de um ácido graxo . Os sabonetes são usados principalmente para lavar , banho , e limpeza . Os sabonetes para limpeza são obtidos tratando óleos e gorduras vegetais ou animais com forte alcalino solução. Gorduras e óleos são compostos de triglicerídeos ; três moléculas de ácidos graxos estão ligados a uma única molécula de glicerol . A solução alcalina, muitas vezes chamada soda cáustica (embora o termo "sabão de soda cáustica" se refira quase exclusivamente a sabonetes feitos com hidróxido de sódio ), provoca um reação química conhecido como saponificação . Nesta reação, as gorduras triglicerídicas são primeiro hidrolisadas em ácidos graxos livres e, em seguida, estes se combinam com o álcali para formar sabão bruto, um amálgama de vários sais de sabão, excesso de gordura ou álcali, água e liberados. glicerol (glicerina). A glicerina é um subproduto útil, que pode ser deixada no sabonete como agente amaciante ou isolada para outros usos.
Como funciona o sabonete?
O sabonete é um excelente limpador devido à sua capacidade de atuar como agente emulsificante. Um emulsificante é capaz de dispersar um líquido em outro líquido imiscível. Isso significa que embora o óleo (que atrai sujeira) não se misture naturalmente com a água, o sabão pode suspender o óleo/sujeira de forma que possa ser removido.

A parte orgânica do Sabonete Natural é uma molécula polar com carga negativa. Seu grupo carboxilato hidrofílico (amante da água) (-CO2) interage com as moléculas de água por meio de interações íon-dipolo e ligações de hidrogênio. A parte hidrofóbica (que tem medo de água) de uma molécula de sabão, sua longa cadeia de hidrocarbonetos apolares, não interage com as moléculas de água. As cadeias de hidrocarbonetos são atraídas umas pelas outras por forças de dispersão e agrupam-se, formando estruturas chamadas micelas. Nessas micelas, os grupos carboxilato formam uma superfície esférica com carga negativa, com as cadeias de hidrocarbonetos dentro da esfera. Por terem carga negativa, as micelas do sabão se repelem e permanecem dispersas na água.
Graxa e óleo são apolares e insolúveis em água. Quando sabão e óleos sujos são misturados, a porção de hidrocarbonetos apolares das micelas quebra as moléculas de óleo apolares. Forma-se então um tipo diferente de micela, com moléculas de sujidade apolares no centro. Assim, a gordura e o óleo e a “sujeira” a eles ligada ficam presos dentro da micela e podem ser enxaguados.
O sabonete é um ácido ou uma base?
O sabão não é totalmente um ácido ou uma base, é um sal básico. É uma combinação de ácido fraco e base forte. Quando um ácido e uma base são combinados em uma certa quantidade, eles formam sal e água. E quando o sal tem uma base mais forte em sua combinação, mostra um caráter básico.
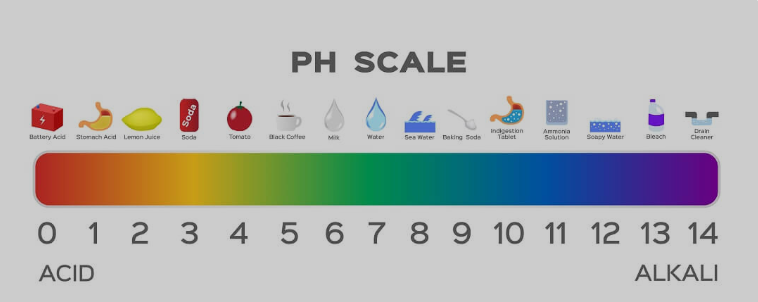
O sabonete é um ácido/base forte ou fraco?
O sabão tem uma natureza básica fraca. Embora bases fortes sejam usadas na fabricação de sabonetes, os ácidos fracos usados na reação neutralizam os efeitos até certo ponto. Quando você usa uma tira de pH para medir, a maioria dos sabonetes apresenta um pH de 9 a 10. Enquanto as bases fortes variam de 12 a 14 na escala de pH.